
ARTÍCULOS ORIGINALES
Caracterización de displasia cortical focal,
en pacientes atendidos en el Hospital Metropolitano, 2010-2021
Characterization of focal cortical dysplasia, in patients treated at the Hospital Metropolitano, 2010-2021

ARTÍCULOS ORIGINALES
en pacientes atendidos en el Hospital Metropolitano, 2010-2021
Characterization of focal cortical dysplasia, in patients treated at the Hospital Metropolitano, 2010-2021
Recibido: 27-09-2022
Aceptado: 20-10-2022
Publicado: 30-12-2022
Revista MetroCiencia
Volumen 30, Número 4, 2022
ISSNp: 1390-2989 ISSNe: 2737-6303
Editorial Hospital Metropolitano
Fabián Marcelo Torres Campoverde1, Emilio Patricio Abad Herrera2
RESUMEN
Introducción: Displasias corticales focales (DCF) son un subgrupo de malformaciones circunscritas del desarrollo cortical. Representan la causa más común de epilepsia refractaria en la población pediátrica y la segunda / tercera causa en adultos. Metodología: Estudio observacional, cuantitativo, descriptivo, retrospectivo, con muestreo por conveniencia. Se incluyeron 107 pacientes con DCF. Se realizó análisis univarial con frecuencias y porcentajes. Chi-cuadrado y diferencia de medias para análisis bivarial. Para medir asociación se utilizó RR (IC 95%). Resultados: La edad media fue 16,85 años, 49,53% mujeres y 50,47% hombres. 14,95% presentó antecedentes de convulsiones febriles, 3,74% fueron asintomáticos. Crisis focales fue la presentación más habitual (67,9%), predominantemente motoras (83,5%). El 11,21% presentó deterioro cognitivo. El 61,68% había sido diagnosticados de epilepsia criptogénica. La edad media de inicio de síntomas fue 11 años. Pacientes con antecedentes de convulsiones febriles presentaron sintomatología más temprana (4,73 años). El 46,7% de DCF se localizó en el lóbulo temporal. Pacientes con DCF tipo III presentaron debut más tardío (13,79 años). 50,77% de los pacientes presentaron epilepsia refractaria. 7,7% fueron sometidos a cirugía. Se encontró asociación entre epilepsia refractaria y deterioro cognitivo (RR 1,9). Pacientes con convulsiones febriles presentaron debut más temprano de epilepsia (4,7 años). Pacientes con deterioro cognitivo presentaron inicio precoz de síntomas (4,58 años). Conclusiones: DCF es causa importante de epilepsia refractaria, 50.7% de los pacientes de este estudio presentaron dicha característica. El inicio de la sintomatología se presenta en edades tempranas. La presencia de crisis farmacorresistentes representa un factor de riesgo para deterioro neurocognitivo.
Palabras clave: Displasia cortical focal, malformación del desarrollo cortical, epilepsia, epilepsia refractaria.
ABSTRACT
Introduction: Focal cortical dysplasias (DCF) are a subgroup of circumscribed malformations of cortical development. They represent the most common cause of refractory epilepsy in the pediatric population and the second/third cause in adults. Methodology: Observational, quantitative, descriptive, retrospective study, with convenience sampling. 107 patients with DCF were included. Univariate analysis was performed with frequencies and percentages. Chi-square and mean difference for bivariate analysis. To measure association, RR (95% CI) was used. Results: The average age was 16,85 years, 49,53% women and 50,47% men. 14,95% had a history of febrile seizures, 3,74% were asymptomatic. Focal seizures were the most common presentation (67,9%), predominantly motor (83,5%). 11,21% presented cognitive deterioration. 61,68% had been diagnosed with cryptogenic epilepsy. The mean age of symptom onset was 11 years. Patients with a history of febrile seizures presented earlier symptoms (4,73 years). 46,7% of DCF were located in the temporal lobe. Patients with DCF type III presented a later onset (13,79 years). 50,77% of the patients presented refractory epilepsy. 7,7% underwent surgery. An association was found between refractory epilepsy and cognitive impairment (RR 1,9). Patients with febrile seizures had earlier onset of epilepsy (4,7 years). Patients with cognitive impairment presented early onset of symptoms (4,58 years). Conclusions: DCF is an important cause of refractory epilepsy, 50,7% of the patients in this study presented this characteristic. The onset of symptoms occurs at an early age. The presence of drug-resistant crises represents a risk factor for neurocognitive impairment.
Keywords: Focal cortical dysplasia, malformation of cortical development, epilepsy, refractory epilepsy.
Fabián Marcelo Torres Campoverde
 https://orcid.org/0000-0001-8494-4698
https://orcid.org/0000-0001-8494-4698
Emilio Patricio Abad Herrera
 https://orcid.org/0000-0002-5504-9755
https://orcid.org/0000-0002-5504-9755
 |
Usted es libre de:Compartir — copiar y redistribuir el material en cualquier medio o formato. |
*Correspondencia: fabistor@hotmail.com
INTRODUCCIÓN
Las malformaciones del desarrollo cortical (MDC) juegan un papel importante en la etiología de la epilepsia. Uno de los subtipos de MCD, la displasia cortical focal (DCF), es particularmente importante como causa frecuente de epilepsia resistente a fármacos. El trastorno es el resultado de la alteración en la migración, proliferación y diferenciación neuronal durante el desarrollo del cerebro, lo que da lugar a anomalías en la laminación cortical regional, la maduración neuronal y la diferenciación. Aproximadamente la mitad (46,5%) de los pacientes epilépticos resistentes a los medicamentos tienen alguna forma de esta patología1-3.
La etiología y patogenia de la DCF aún es incierta; sin embargo, muchos hallazgos histopatológicos y moleculares apuntan a procesos anormales de proliferación y migración neuronal y glial. La hipótesis del daño extrínseco postula que el daño al cerebro en desarrollo se debe a factores extrínsecos, como isquemia, hipoxia o toxinas. La hipótesis alternativa de la mutación somática apunta a una célula progenitora cortical mutante para producir una población clonal de células anormales, formando lesiones DCF2.
Otra teoría sobre la patogénesis de la DCF de Chen et al. se basa en la cepa del virus HPV16 y su oncoproteína E6 en el cerebro fetal en desarrollo. Se demostró la correlación funcional entre la expresión de la oncoproteína E6 de HPV16 y el desarrollo de malformaciones corticales focales asociadas con la señalización mejorada del complejo 1 (mTORC1) de rapamicina (mTOR) en mamíferos en un modelo animal4,5.
Desde las primeras descripciones de DCF, quedó claro que la característica sine qua non de DCF era desorganización de la citoarquitectura de la corteza cerebral. La estructura hexalaminar normal de la corteza está desorganizada o completamente perdida.Todos los subtipos de DCF pueden presentar algún grado de alteración en los límites de la materia gris-blanca, y neuronas heterotópicas a menudo se observan en la sustancia blanca subcortical6-9.
Interacciones complejas entre neuronas y desequilibrio en los neurotransmisores inhibidores y excitadores son los mecanismos conocidos de epileptogénesis en DCF. La sobreexpresión de las subunidades del receptor AMPA y NMDA causan un aumento de los estados de excitación2,10.
Por contrapartida, la composición anormal de las subunidades del receptor GABA, pérdida de neuronas GABAérgicas, respuestas GABA alteradas, alteración de la inhibición sináptica de neuronas piramidales debido a defectos migratorios en el neurodesarrollo, y la mala distribución de las interneuronas causan una disminución de los estados de neuroinhibición. La epileptogénesis es el resultado de comunicación entre células inmaduras, células maduras y redes neuronales2.
Es difícil extraer información sobre la prevalencia de DCF debido a los diferentes criterios en la selección y en lo métodos de investigación aplicados en los datos notificados. En cada estudio la diversidad en los métodos de investigación conduce a cierto sesgo de muestreo. En el diagnóstico de la epilepsia focal la prevalencia de la DCF oscila entre el 5 y el 25%, según el colectivo de pacientes y las técnicas de imagen11,12.
Palmini y col. describieron el sistema de clasificación más utilizado anteriormente según la presencia de neuronas dismórficas. Hay dos tipos: en el tipo I, hay alteración de la laminación cortical sin neuronas dismórficas; sin embargo, en el tipo II, observaron neuronas dismórficas. Ambos tipos tienen subgrupos; el tipo Ib indica la presencia de anomalías citoarquitectónicas de las neuronas piramidales, y el tipo IIb contiene células globo2,13.
Recientemente, el Grupo de Trabajo de la International League Against Epilepsy (ILAE) ha declarado una clasificación más nueva y detallada (Tabla 1). Un tipo adicional de DCF se incluye en la clasificación de ILAE de manera diferente a la de Palmini: DCF tipo III se refiere a una patología "dual" o coexistente, en la que la displasia se acompaña de otra anomalía patológica14.
La manifestación más frecuente causada por la DFC es la epilepsia refractaria a fármacos; generalmente, de aparición temprana en la infancia, independientemente de la localización o el tamaño de la lesión. En un estudio de 120 pacientes diagnosticados con DCF, el 92,5% de ellos tuvo un inicio de epilepsia antes de los 16 años y el 61% antes de los 5 años. La ubicación anatómica de la DCF determina la semiología de las convulsiones15.
Diversos estudios encontraron que los pacientes con DCF IIa tenían un inicio de epilepsia más tardío en comparación con los pacientes con DCF IIb. En la epilepsia del lóbulo temporal la DFC tipo I es más frecuente, y en la epilepsia extratemporal la DFC tipo II es más frecuente. Independientemente de la semiología, las convulsiones refractarias y mal controladas contribuyen al deterioro cognitivo en niños y adultos. Otras presentaciones clínicas incluyen retraso en el desarrollo, problemas de comportamiento, trastornos del espectro autista y, a veces, déficits neurológicos focales2,16.
Antes del desarrollo de la imagen por resonancia magnética (RM), Taylor et al. fueron los primeros en describir malformaciones de la migración neuronal en 1971. Después del desarrollo de la resonancia magnética en la década de 1980, estas lesiones comenzaron a reconocerse en pacientes con epilepsia focal "criptogénica". A medida que la tecnología de resonancia magnética avanzó utilizando imanes 3T, 7T y protocolos detallados de imágenes de epilepsia, se reconocieron lesiones más pequeñas14,17.
En la resonancia magnética, las características de DCF son un aumento del grosor cortical (60–91 % de DCF), una unión de sustancia gris/blanca borrosa (74–96 % de DCF), un signo de transmanto (75 % de DCF tipo IIa, 94 % de DCF tipo IIb), y/o un patrón de giro/surco anormal. Las anormalidades de RMN de DCF a menudo son sutiles y, como generalmente no cambian durante la vida, a menudo se pasan por alto. La variabilidad en la prevalencia de la lesión depende del protocolo de resonancia magnética y la familiaridad del neurorradiólogo. No todos los pacientes con MRI (+) DCF desarrollan convulsiones, hasta el 29 % de las RMN (+) no desarrollan epilepsia en los niños, lo que resultó en una definición novedosa llamada "DCF asintomática"18,19.
El EEG en los espasmos debidos a DCF a menudo muestra un predominio ictal asimétrico o lateralizado, anomalías epileptiformes focales y enlentecimiento de fondo focal. En el 71% de los pacientes, los patrones de EEG ictal pueden extenderse a regiones más remotas, volverse bilateralmente sincrónicos o generalizarse con el tiempo, particularmente en niños con un inicio temprano de convulsiones antes de los 5 años. Las series rítmicas o cuasi continuas de espigas interictales u ondas agudas en el EEG de superficie son típicos de la DCF20.
El tratamiento de la DCF que se basa en la presentación clínica del paciente es principalmente sintomático, e incluye lo siguiente: tratamiento del déficit cognitivo y/o neurológico y manejo de las convulsiones. El tratamiento antiepiléptico sigue siendo un desafío, considerando el hecho de que generalmente se sabe que la DCF causa epilepsia resistente a los medicamentos y la razón principal de la resistencia parece ser multifactorial.
En estas circunstancias, la resección quirúrgica es el tratamiento óptimo para las lesiones epileptógenas resistentes a fármacos. La ausencia de convulsiones y los resultados cognitivos e intelectuales se ven afectados positivamente por la resección quirúrgica de la lesión displásica20,21.
Las características clínicas de los pacientes con displasia cortical focal se encuentran dentro de un rango amplio, por lo cual es necesaria la caracterización de los pacientes que presentan DCF en nuestra área geográfica. La importancia de este trabajo de investigación recae en el hecho de que no se dispone de información de calidad respecto a las características epidemiológicas y clínicas de los pacientes con displasia cortical focal en nuestro medio; es evidente la falta de estudios descriptivos y analíticos que nos permitan determinar las características propias de nuestros pacientes y enfocar su terapéutica con base en evidencia.
Los datos obtenidos a través de este estudio permitirán entender de mejor manera las particularidades de los pacientes con DCF en cuanto a su epidemiología y presentación clínica y de esta manera guiar la terapéutica en función de la evidencia adaptada a nuestra realidad.
MATERIALES Y MÉTODOS
Diseño del estudio
Se trata de un estudio de tipo observacional, descriptivo, retrospectivo, mediante revisión de expediente clínico y de reporte imagenológico, de pacientes diagnosticados con displasia cortical focal en las áreas de hospitalización y consulta externa de neurología del Hospital Metropolitano de Quito, en el periodo enero 2010-diciembre de 2021.
Población y muestra
La población en este estudio estuvo constituida por todos los pacientes con diagnóstico de DCF. Debido a la baja prevalencia de la enfermedad en los estudios revisados, se realizó un muestreo por conveniencia. Se logró incluir en este estudio a 107 pacientes. Se incluyeron a todos los pacientes con diagnóstico de displasia cortical focal, en el periodo de tiempo mencionado. Fueron excluidos los pacientes con expediente clínico incompleto, en el que no constaban las variables de nuestro estudio.
Variables principales
Las principales variables del estudio fueron: edad media de los participantes al momento de su inclusión al estudio, sexo, antecedentes de convulsiones febriles, principales comorbilidades asociadas, ausencia de síntomas, clasificación de acuerdo con sus características clínicas, ILAE y Palmini, edad de inicio de síntomas, hallazgos imagenológicos principales y EEG, localización de la lesión DCF, tratamiento utilizado, y respuesta a la terapéutica.
Recolección de datos y análisis estadístico
Recolección de datos mediante un formulario estructurado con datos obtenidos del expediente clínico y de reporte imagenológico, de la base de los datos Excel® se extrapolaron los datos para su respectivo análisis, para lo cual se empleó el programa estadístico IBM SPSS® versión 25.0
Para las variables cualitativas se describieron en frecuencias y porcentajes. Para las variables cuantitativas se hizo la descripción de medidas de tendencia central y de dispersión. Análisis bivarial de variables cualitativas Chi2 y test de diferencia de medias (t student y ANOVA). Intervalos de confianza al 95%, y un nivel de significancia estadística p < 0,05. Para medir la fuerza de asociación se utilizó en RR (riesgo relativo).
Aspectos bioéticos
Esta investigación no implica algún tipo de intervención experimental con los pacientes incluidos en el estudio. Para garantizar la confidencialidad de los datos recogidos en la revisión de los expedientes clínicos, se prescindió de datos personales identificables o cualquier otra información que pudiese facilitar la identificación de estos, respetando lo especificado en la declaración de Helsinki del 2008.
Análisis y reporte de estudios diagnósticos
Los estudios imagenológicos fueron revisados e informados por el equipo de neurorradiólogos del Hospital Metropolitano, a partir de los cuales se extrajeron los datos utilizados en este estudio. Dicho equipo cuenta con la experticia necesaria para el diagnóstico imagenológico de DCF. Ningún neuropatólogo estuvo implicado en el estudio debido al escaso número de pacientes sometidos a resección quirúrgica implicados en este estudio.
Los estudios de electroencefalograma no fueron realizados en un único centro, ni interpretados por el mismo profesional. Cuando los estudios de EEG fueron realizados en otro centro, no siempre fue posible contar con reporte. En todo caso, cabe mencionar que los resultados fueron validados por el neurólogo clínico a cargo de cada paciente.
Seguimiento de pacientes quirúrgicos
El seguimiento de los pacientes intervenidos quirúrgicamente estuvo a cargo del equipo conformado por el neurocirujano responsable de la cirugía y el neurólogo / epileptólogo clínico. El tiempo promedio de seguimiento fue de 5,3 años.
Resultados
Se incluyeron a 107 pacientes con displasia cortical focal, la edad media fue de 16,85 años, una moda de 5 años, con una mínima de 0 años y un máximo de 69 años, con una distribución respecto a sexo de 50,47% masculinos y 49,53% femenino.
El 14,95% de los pacientes con displasia cortical focal en este estudio presentan antecedentes de convulsiones febriles. De los 107 pacientes con DCF participantes en este estudio, el 3,74%, fueron asintomáticos. El 67,96% presentan un origen focal, el 29,13% un origen generalizado y el 2,91% presentaron un origen desconocido. El 83,5% presentaron crisis de origen motor y el 16,5% presentaron crisis de origen no motor.
De acuerdo con las características clínicas, de los 103 pacientes sintomáticos, el 28,16% presentaron crisis focales a tónico-clónicas, 19,42% presentaron crisis tónicas, el 14,56% presentaron crisis de ausencia, el 12,62% tuvieron crisis de tipo tónico-clónico generalizado. Además, el 10,68% manifestaron crisis de tipo mioclónico, el 7,77% presentaron crisis clónicas.
El 11,2% de los pacientes con diagnóstico de displasia cortical focal, presentaron algún grado de deterioro cognitivo. Además, el 7,48% de los pacientes con displasia cortical focal incluidos en este estudio, presentaron antecedentes de trastornos psiquiátricos.
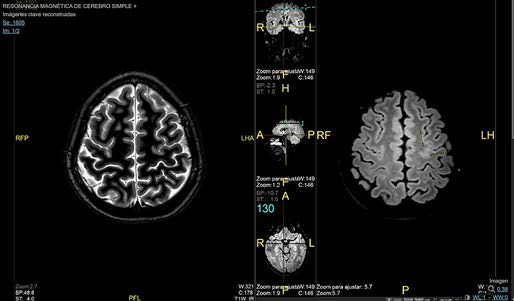
Los hallazgos más frecuentes observados en resonancia magnética, compatibles con el diagnóstico de DCF. Fueron la hipoplasia-atrofia cortical en el 48,6% de los pacientes, seguida por el engrosamiento cortical (Imagen 1) que representa el 29% de los hallazgos, en tercer lugar, tenemos a la hiperintensidad cortical, encontrando este hallazgo hasta en el 21,5% de los casos. A continuación, tenemos a la esclerosis temporal mesial con un 17,8% y el blurring con un 15%.
De acuerdo con la clasificación para la displasia cortical focal, establecida en 2018 por la ILAE; en nuestro estudio identificamos que el tipo predominante es el IIA con el 33,64% (n=36) de los casos, seguido por el tipo IA con el 24,3% (n=26). El tipo IIIB fue el menos frecuentemente encontrado en los participantes de nuestro estudio. De acuerdo con la localización del área de alteración del desarrollo cortical, la localización más frecuente de DCF fue en el lóbulo temporal en un 46,73% de los casos, a continuación, tenemos al lóbulo frontal con el 26,17% de los casos y en tercer lugar con el 8,41% de los casos observamos que la lesión se ubicó a nivel frontotemporal. En un 57,95% de los casos, la lesión se ubicó en el hemisferio izquierdo.
En cuanto a la respuesta al tratamiento, hasta el 50,77% de los pacientes previamente tratados presentaron epilepsia catalogada como refractaria al tratamiento. Únicamente, se observó una respuesta completa en un 7,69% de los casos.
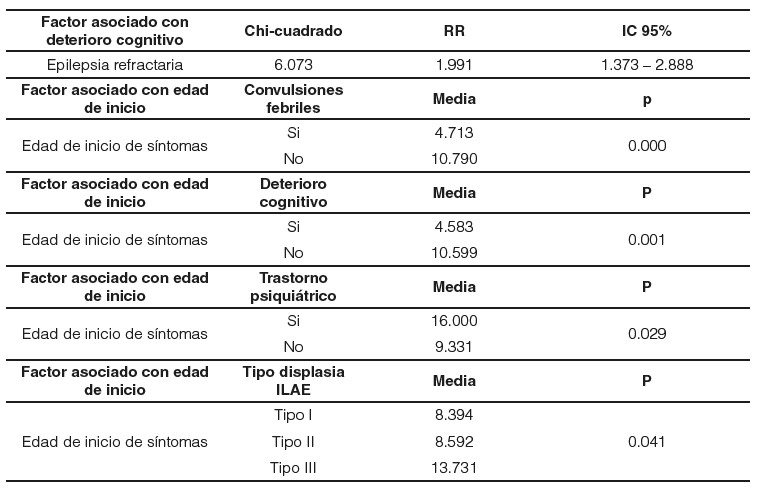
Los pacientes con antecedentes de convulsiones febriles presentaron un inicio más temprano de epilepsia en comparación a los que no manifestaron este antecedente (4,713 VS.10,790 años). Los pacientes que iniciaron con síntomas más temprano tienen mayor riesgo de presentar deterioro cognitivo (4,583 VS. 10,599 años). Los pacientes con DCF tipo I presentaron un inicio de síntomas más temprano (8,394 años de media) y los de tipo III presentaron un debut más tardío (media de 13,731 años). Los resultados del análisis bivariado se resumen en la tabla 2.
Discusión
Para el presente estudio se incluyeron 107 pacientes con diagnóstico de displasia cortical focal, la edad media de los participantes fue de 16,85 años, con una distribución prácticamente igual para hombres y mujeres. Lo cual sigue la línea de lo descrito en la bibliografía. Por ejemplo, en la revisión de 120 pacientes realizada por Fauser y colaboradores en 2006, hasta el 92,5% de los pacientes debutaron con sintomatología antes de los 16 años; lo cual explica la edad media encontrada en nuestro trabajo22.
El 14,95% de los pacientes DCF, presentaron antecedentes de convulsiones febriles. Hallazgos similares a los descritos por Gaitanis y Donahue, se describe que los pacientes con DCF ocasionalmente debutan con episodios convulsivos en la infancia temprana asociados con episodios febriles23. Además, identificamos que aquellos pacientes con antecedentes de convulsiones febriles presentaron un debut más temprano de epilepsia en comparación con aquellos pacientes que no manifestaron dicho antecedente (4,71 VS. 10,7 años).
Se ha descrito ampliamente en la literatura que la displasia cortical focal puede cursar en forma asintomática. Como describen D´Gama y Walsh, no se conoce con precisión el porcentaje de pacientes asintomáticos; ya que, la mayoría de los estudios provienen de reporten de casos o reportes quirúrgicos en pacientes con epilepsia refractaria. En nuestro estudio, el 3,74% de los casos de DCF fueron asintomáticos, descubiertos como hallazgo incidental o en imágenes indicadas por otras causas24. Sin embargo, Feng y Khandelwal reportaron que hasta el 29% de los pacientes con hallazgos imagenológicos con DCF fueron asintomáticos17,18.
En relación con las características clínicas de las crisis convulsivas, encontramos que el 67,96% de las crisis tuvieron un inicio focal, principalmente motoras (83,5%). Se observó un predominio de crisis focales motoras con posterior generalización a tónico clónicas (previamente conocidas como crisis parciales complejas). Los datos de nuestro estudio coinciden con lo descrito por otros autores13,23.
El 11,21% de los pacientes con displasia cortical focal, presentaron algún grado de alteración del desarrollo o déficit neurocognitivo. Por contrapartida, en el estudio publicado por Wong y Kisiel, reportan una prevalencia de hasta 79% de los pacientes con déficit neurocognitivo; sin embargo, las características muestrales difieren significativamente, en su estudio se incluyen pacientes con epilepsia refractaria sometidos a cirugía por DCF, lo cual explica las diferencias encontradas20.
De acuerdo con lo publicado por Kwon, la edad de inicio de las convulsiones afecta en mayor medida las características psiquiátricas. La comorbilidad psiquiátrica es más común en pacientes con lesiones posteriores y epilepsia de inicio temprano16. Sin embargo, en nuestro estudio, se observó que la presencia de trastornos psiquiátricos fue más común en pacientes con inicio más tardío de los síntomas (16,0 años)
Se describe que existe un importante porcentaje de pacientes con displasia cortical focal que han sido diagnosticados de “epilepsia criptogénica” debido principalmente a la falta de estudios de imagen de calidad suficiente y a que las lesiones de DCF no siempre son visibles en estudios de imagen. Es así como, en nuestra investigación, encontramos que hasta el 61,68% de los pacientes finalmente diagnosticados con DCF, previamente habían sido diagnosticado de epilepsia criptogénica.
La edad de inicio de síntomas en nuestra investigación fue de media 11,069 años con una mediana de 8 años. Según lo descrito por Maynard, hasta el 60% de los pacientes con DCF desarrollan síntomas antes de los 5 años, el 90% antes de los 16 años y solo el 10% debutan con síntomas en la adultez12.
En relación con los hallazgos predominantes en estudios de imagen, la bibliografía internacional reporta que el hallazgo más frecuente es el blurring o borramiento de la unión gris-blanca. El hallazgo más frecuente en nuestra muestra fue la hipoplasia / atrofia focal, seguido por el engrosamiento cortical y la hiperintensidad cortical (48,6%-29% y 21,5%, respectivamente)25.
En lo relativo a clasificación, existe discrepancias entre los diferentes artículos consultados; debido a que los sistemas de clasificación han sufrido cambios y actualizaciones recientes. Si nos basamos en el último sistema de clasificación de la ILAE del 2018, en nuestro estudio encontramos que el 36,45% de los pacientes se encontraban dentro del tipo I, el 37,38% en el tipo II (33,64% tipo IIa y 3,74% tipo IIb) y 26,17% tipo III (16,82% IIIa, 0.93% Tipo IIIb, 1,87% IIIc y 6,54% IIId)
Respecto a la localización habitual de las DCF, los resultados son contradictorios y dependen fundamentalmente de las características muestrales; sin embargo, tal como describen Tahta y Maynard, la mayoría de los hallazgos se localizan a nivel de lóbulos temporal y frontal
En nuestro caso, el 46,73% de los casos se localizaron a nivel temporal y el 26,17% a nivel frontal, observamos un predominio izquierdo de las lesiones2,12.
El 59,81% de los pacientes mostraron concordancia entre la localización del foco epileptogénico identificado por EEG de superficie y la localización anatómica de DCF. Lo cual difiere de lo descrito por otros autores como Gaitanis y más recientemente D’Gama, quienes encontraron una correlación cercana al 80% con el EEG de superficie. Sin embargo, en nuestro estudio, en el 17,76% de los casos no se pudieron obtener los resultados del EEG por lo que el porcentaje real de concordancia es incierto23,24.
La tasa de epilepsia médicamente refractaria sigue sin estar clara porque los estudios quirúrgicos informan solo sobre pacientes en los que fracasó el tratamiento médico y, por lo tanto, fueron evaluados para cirugía26. Un estudio reciente de casi 100 pacientes con DCF positivo en RMN encontró que el 46% de los pacientes con DCF y epilepsia desarrollaron epilepsia intratable12. Datos compatibles con lo identificado en nuestro estudio, en el cual, la tasa de epilepsia refractaria alcanzó el 50,77%.
En el presente estudio identificamos que existe una asociación entre epilepsia refractaria y deterioro cognitivo. Los pacientes con epilepsia refractaria tienen 1,99 veces más riesgo de presentar deterioro cognitivo. Otro factor asociado con el deterioro neuro-cognitivo fue la edad de inicio de la sintomatología; es así como, aquellos pacientes que mostraron deterioro cognitivo tuvieron un inicio precoz de los síntomas (4,53 años) en comparación con los pacientes sin déficit (10,59 años).
Kwon describió que el tamaño de la lesión, localización de la lesión, tipo de convulsión, aparición y la persistencia de las convulsiones, y el tipo de DCF afectan la gravedad del retraso neurocognitivo. Lesiones más grandes, tipo DCF (la probabilidad de retraso neurocognitivo es menor en el tipo II que en el tipo I), región temporal u occipital, inicio temprano y persistencia más prolongada de las convulsiones causan los retrasos más graves en desarrollo neurocognitivo16.
Widdess-Walsh y colaboradores observaron tasas más altas de deterioro cognitivo en DCF tipo II versus DCF tipo I. El deterioro cognitivo también es más común en pacientes con un inicio temprano de la epilepsia27. Gaitanis y colaboradores informaron que el inicio más temprano de las convulsiones se asoció con discapacidad intelectual23.
En nuestro estudio encontramos diferencias significativas en la edad de inicio de los síntomas y los diferentes subtipos de DCF. Los pacientes con DCF I presentaron un inicio más temprano y los pacientes con DCF III un inicio más tardío de los síntomas (8,3 VS. 13,7 años). Palmini describió que en comparación con los pacientes con DCF I, los pacientes con DCF II suelen ser más jóvenes al inicio de las convulsiones, tienen una mayor frecuencia de convulsiones y son más jóvenes en el momento de la cirugía de epilepsia25.
Conclusiones
La edad media de los participantes en el estudio fue de 16,85 años. El 14,95% de los pacientes tuvieron antecedentes de convulsiones febriles. El 11,21% de los casos manifestaron deterioro neurocognitivo y el 7,48% de pacientes tenían trastorno psiquiátrico.
El 3,74% del total de pacientes con displasia cortical focal fueron asintomáticos al momento de su inclusión en el estudio. De los 96,25% de pacientes sintomáticos, el 67,96% presentaron crisis de inicio focal y el 29,13% de inicio generalizado. El 83,5% de las crisis fueron de tipo motor. De acuerdo con las características clínicas mostradas, el tipo más habitual de crisis fueron las de tipo focal con generalización a tónico-clónico.
El 61,68% de los pacientes con DCF tenían un diagnóstico previo de epilepsia criptogénica. La edad media de inicio de los síntomas fue de 11.069 años.
El 50,77% de los casos presentaron epilepsia refractaria o fármaco-resistente. Los pacientes con epilepsia refractaria tienen un riesgo 1,99 veces mayor de presentar deterioro cognitivo.
Los pacientes con antecedentes de convulsiones febriles presentaron un inicio más temprano de epilepsia en comparación a los que no manifestaron este antecedente (4,713 VS. 10,790 años). Los pacientes que iniciaron con síntomas más temprano tienen mayor riesgo de presentar deterioro cognitivo (4,583 vs 10,599 años)
Los pacientes con DCF tipo I presentaron un inicio de síntomas más temprano (8,394 años de media) y los de tipo III presentaron un debut más tardío (media de 13,731 años)
Limitaciones
Entre las limitaciones encontradas durante la realización del presente estudio podemos mencionar que existe un porcentaje importante de pacientes que no cuentan con un reporte electroencefalográfico dentro de su historia clínica; además, frecuentemente se pudo acceder únicamente a los reportes de EEG sin poder contar con los trazos correspondientes; lo cual, obedece a causas como la omisión de los reportes / trazos en la historia clínica y la realización del EEG en la consulta médica fuera del hospital.
Otra limitación fue la falta de estandarización en los criterios de los neurorradiologos encargados de la revisión de las resonancias magnéticas. Todos los neurorradiologos cuentan con la experticia necesaria para evaluar los estudios de imagen; sin embargo, debido al intervalo de tiempo prologado para la inclusión de pacientes (2010-2021) existen importantes cambios en la calidad de los equipos tecnológicos, criterios de clasificación de DCF y estandarización de criterios diagnósticos.
Contribución de los autores
Dr. Fabián Torres por la concepción y diseño del trabajo, recolección, análisis estadístico e interpretación de los datos; además, redacción del manuscrito. Dr. Patricio Abad por la concepción y diseño del trabajo y revisión crítica del manuscrito.
Conflicto de interés
Los autores declaran no tener conflictos de intereses y ser los autores del material presentado, el mismo que es inédito.
Financiación
La elaboración de este artículo no recibió financiamiento de ninguna organización o persona en particular.